La dynamique interne de la terre
1

La dynamique interne de la terre
1

La mobilité horizontale
des plaques lithosphériques
La mobilité horizontale
des plaques lithosphériques

Des édifices ordonnés : les CRISTAUX
L'état cristallin est une forme d'organisation de la matière que l'on retrouve à la fois dans les minéraux, les roches mais aussi les os de notre squelette !
Certains cristaux peuvent être précieux, certains sont minuscules tandis que d'autres sont gigantesques (comme ceux de la grotte de Naïca au mexique, sur les photo / vidéo ci-dessous)
L' exemple du Chlorure de sodium un solide ordonné
Le chlorure de sodium ou halite (présent dans les roches ou issu de l'évaporation de l'eau de mer) est couramment appelé "sel de table". C'est un solide de formule NaCl.
> Relier l'organisation microscopique du cristal
à sa structure macroscopique
Démarche expérimentale
observez des cristaux de sels à différentes échelles
-
à l'oeil nu
-
à la loupe binoculaire
-
au microscope polarisant (LPA)
Pour compléter cette étude on peut observer la représentation 3D du chlorure de sodium

Démarche expérimentale
Utilisez le logiciel MinUSc (Minéraux à Usage Scolaire)
-
Dans l'onglet fichier tapez "halite"
-
Dans l'onglet commandes changez les diverses possibilités pour
- étudier la structure de la maille cristalline, essayez notamment de multiplier la maille selon les 3 axes (a, b, c)
-visualiser l'empillement des atomes.
- comprendre la répartition des charges -
Dans l'onglet formule remplissez le tableau pour comprendre le comptage des atomes partagés entre les mailles

En comparant la forme géométrique microscopique et la forme géométrique des cristaux de sel à l'oeil nu on peut voir une correspondance.
La structure du cristal est due à la répétition d'un motif cubique qu'on appelle "la maille".
Un réseau cristallin est formé par la répétition de la maille élémentaire.
Le sel, chlorure de sodium, aussi nommé halite, est composé de 2 sortes d'ions :
-
Na+ ion sodium
-
Cl- ion chlorure
Ces ions sont empilés de façon régulière et ordonnée, c'est ce qui caractérise un "cristal" ou "l'état cristallin".
Les ions chlorures Cl- occupent tous les sommets et les centres des faces du cube, tandis que les ions sodium Na+ occupent le centre du cube et le milieu de toutes les arêtes.
Un cristal peut être constitué de différentes entités :
ions, mais aussi atomes ou molécules.
Bilan 1 :
Une structure cristalline est définie par une maille élémentaire répétée périodiquement.
Source : Manuel 1ES Hatier
> Savoir décrire et caractériser les solides cristallins
Décrire et caractériser les solides cristallins

Pour définir le type cristallin il faut :
- représenter la maille en perspective cavalière
- indiquer la position des entités qui le composent.
-
Le Polonium est de type "cubique simple".
-
Le Cuivre est de type "cubique à faces centrées".
dans les 2 cas à l'échelle microscopique la forme géométrique qui les représente est un cube.
Bilan 2 :
Un type cristallin est défini par la forme géométrique de la maille, la nature et la position dans cette maille des entités qui le constituent.
Les cristaux les plus simples peuvent être décrits par une maille cubique que la géométrie du cube permet de caractériser.
La position des entités dans cette maille distingue les réseaux cubique simple et cubique à faces centrées.
> Dénombrer les atomes par maille
et calculer la compacité

Source : Manuel 1ES HATIER
Calcul du nombre d'atomes par maille:
Une maille de Polonium contient 8 fractions de 1/8e d'atome soit l'équivalent de 1 atome de Polonium.
Une maille de Cuivre contient 8 fractions de 1/8e d'atome et 6 fractions de 1/2 atome soit l'équivalent de 4 atomes de Cuivre.
Calcul de la compacité du Polonium et du Cuivre


> Calculer la masse volumique du cristal


Déterminer la masse volumique de façon expérimentale
Source : Manuel 1ES HATIER
Bilan 3 :
La structure microscopique du cristal conditionne certaines de ses propriétés macroscopiques, dont sa masse volumique.
> Distinguer, en termes d'échelle et d'organisation spatiale, maille, cristal, minéral, roche.

Source : Manuel 1ES HATIER



Source : Manuel 1ES BELIN

Source : Manuel 1ES BELIN

Source : Manuel 1ES BELIN

Source : Manuel 1ES BELIN
Bilan 4 :
Un composé de formule chimique donnée peut cristalliser sous différents types de structures qui ont des propriétés macroscopiques différentes.
Ainsi les minéraux se caractérisent par leur composition chimique et leur organisation cristalline.
Une roche est formée de l'association de cristaux d'un même minéral ou de plusieurs minéraux.
> Découvrir des structures cristallines
chez les êtres vivants

Nacre sur la coquille d'ormeau
La nacre est le revêtement intérieur de la coquille sécrétée par le mollusque tout au long de sa vie.
Nacre observée au microscope électronique à balayage
La nacre est constituée à 5% de matière organique et à 95 % de matière minérale : des cristaux d'aragonite de formule CaCo3.
La nacre est 3000 fois plus dure que l'aragonite pure, elle présente une très grande rigidité et une grande résistance à la compression.


Raphides observées au microscope polarisant
Les raphides sont de fins cristaux d'oxalate de calcium ou de carbonate de calcium, présents dans les feuilles ou les tiges de très nombreuses familles de plantes.
Lorsqu'un herbivore consomme une plante contenant des raphides, ceux-ci peuvent blesser la muqueuse de la bouche ou de l'oesophage.
Si la plante contient en plus des substances toxiques cela peut favoriser l'intoxication de l'animal...

Des cristaux dans les os !
La partie externe de l'os (l'os cortical) est un tissu compact capable de supporter de forte pressions.
Ce tissu est composé d'ostéons cylindriques abritant les cellules osseuses (ostéocytes) entourées de lamelles de collagène et de cristaux d'hydroxyapatite.
Plus la quantité d'hydroxyapatite dans l'os est importante plus la densité minérale osseuse (DMO) est élevée.
On détermine la DMO sur une image de l'os grâce rayons X, elle est exprimée en g/cm2.
Les médecins se basent sur cette DMO pour évaluer le taux de fracture d'un patient.
Des cristaux dans l'urine !
La lithiase urinaire est une maladie caractérisée par la formation de "calculs" (du latin calculus qui signifie caillou) à partir de minéraux dissous dans l'urine.
La taille des calculs peut varier d'un grain de sable à celle d'une balle de golf...
En grandissant ils peuvent obstruer les voies urinaires et provoquer de violentes douleur (dites "coliques néphrétiques").

Bilan 5 :
Des structures cristallines existent aussi dans les organismes biologiques (coquille, squelette, calcul rénal ...)
> Mettre en relation la structure amorphe ou cristalline d'une roche et les conditions de son refroidissement.
Le verre,
un solide où règne le désordre !
Le verre a été inventé par l'Homme dans le bassin méditérrénéen, en observant l'effet de la chaleur sur du sable.
Les premiers objets en verre datent d'environ 2500 avant J.-C et ont été retrouvés en Egypte et au Proche-Orient.
Le verre est un matériau amorphe (sans forme) = non cristallin, les atomes qui le constituent sont diposés de façon totalement désordonnée.
Le verre est principalement formé de silice (SiO2).
L'analyse microscopique montre que les atomes de silicium et d'oxygène ne suivent pas un arrangement ordonné.
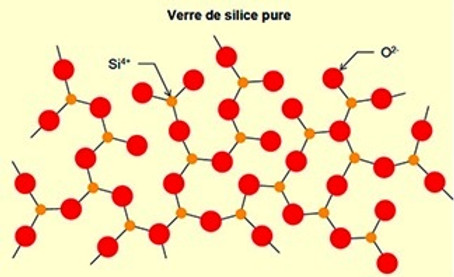
Le verre volcanique
& les solides amorphes
Les roches magmatiques sont issues du refroidissement d'un magma.
Selon les conditions de refroidissement les roches de même nature vont avoir des structures différentes :
-
plus le refroidissement est lent plus les cristaux seront gros.
-
A l'inverse plus le refroidissement est rapide, plus les cristaux seront petits, voire même inexistants !
Ainsi la structure de la roche conserve les conditions de refroidissement.
La vitesse de refroidissement peut varier notamment avec la profondeur, en effet à grande profondeur le refroidissement d'un magma cristallisant en granite peut prendre plusieurs milliers d'années.
Donc un refroidissement en quelques semaines peut être considéré comme "rapide" par un géologue.

Source : Manuel 1ES BORDAS

Source : Manuel 1ES BORDAS

Source : Manuel 1ES BORDAS
Bilan 6 :
Dans le cas des solides amorphes, l'empilement d'entités se fait sans ordre géométrique. C'est le cas du verre.
Certaines roches volcaniques contiennent du verre, issu de la solidification très rapide d'une lave.
Des exercices pour s'entraîner

Source : Manuel 1ES BORDAS

Source : Manuel 1ES BORDAS

Source : Manuel 1ES BORDAS




